Wechselwirkungen von Genen und Umwelt als Grundlage von Depression
Forschungsbericht (importiert) 2012 - Max Planck Institut für Psychiatrie
Depression und Gen-Umwelt-Interaktion
Das menschliche Gehirn ist eine der komplexesten Strukturen in unserem Universum. Schätzungen zufolge sind im Gehirn des Menschen etwa 100 Milliarden Nervenzellen miteinander vernetzt. Da jede dieser Nervenzellen im Schnitt etwa 10.000 Verbindungen zu weiteren Nervenzellen eingeht, ist das Gehirn im Ganzen unvorstellbar kompliziert. Bei einer solch hohen Komplexität ist es nicht verwunderlich, dass es in diesem System auch zu Fehlfunktionen kommen kann, welche ab einem gewissen Grad als psychiatrische oder neurologische Erkrankung wahrgenommen werden. Von allen psychischen Störungen, zu denen unter anderem auch Demenz, Psychosen oder Sucht gehören, kommen sog. affektive Störungen am häufigsten vor, und hier vor allem Angsterkrankungen und Depression. Die affektiven Störungen zeichnen sich durch eine klinisch bedeutsame Veränderung der Stimmungslage aus.
Die Forschung der letzten Jahrzehnte hat gezeigt, dass der Depression sehr komplizierte Mechanismen zu Grunde liegen, die sowohl genetische als auch umweltbedingte Ursachen haben. Es wurde nachgewiesen, dass Stress einen der Haupt-Risikofaktoren für affektive Erkrankungen darstellt. Der Begriff Stress beschreibt einen Zustand, der durch interne oder externe Stimuli ausgelöst wird, die das Gleichgewicht des Organismus (Homöostase) aus der Balance bringen. Dies führt zur Aktivierung von physiologischen Systemen, die für die geeignete Reaktion des Körpers in Bezug auf Stress verantwortlich sind und dafür sorgen, dass der Organismus für die Anforderungen seiner Umgebung optimal gewappnet ist. Das Stresssystem ist daher in erster Linie adaptiv und hilfreich, kann aber durch Überaktivierung auf Grund von lang andauernden Stressperioden auch Krankheiten wie die Depression fördern [1]. Chronischer oder traumatischer Stress führt aber nicht bei allen Personen unweigerlich zu einer Depression, da die genetische Veranlagung für eine erhöhte Stressanfälligkeit hierbei eine große Rolle spielt. FKBP5 ist eines der vielversprechendsten Kandidatengene, das sowohl die Funktion des Stresshormonsystems beeinflusst als auch in genetischen Studien als assoziiert mit Stress und affektiven Störungen gefunden wurde.
FKBP5 als Kandidatengen für Depression
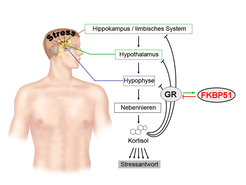
Abb. 1: Das Stresshormonsystem wird durch die Stimulation von Hirnregionen wie dem Hippokampus oder dem Hypothalamus aktiviert und führt über eine hormonelle Kaskade letztendlich zu einer vermehrten Ausschüttung des Stresshormons Kortisol aus der Nebennierenrinde. Die Effekte von Kortisol werden über Stresshormonrezeptoren, wie z. B. den Glukokortikoidrezeptor (GR), vermittelt. FKBP51, kodiert vom FKBP5-Gen, ist ein Ko-Chaperon des GR und fungiert hierbei als funktioneller Antagonist.
Das FKBP5-Gen kodiert für ein Protein, an welches das aus Bakterien gewonnene, immunsuppressiv wirkende Molekül FK506 (Tracolimus) bindet. Es gehört zur Familie der Immunophiline und fungiert unter anderem als Ko-Chaperon in Stresshormonrezeptor-Komplexen. In diesem Komplex bewirkt FKBP5 eine Verminderung der Affinität des Steroidrezeptors für das Stresshormon (Kortisol bei Menschen, Kortikosteron bei der Maus) und wirkt daher als funktioneller Antagonist, das heißt es mindert die biologische Wirkung des durch Kortisol aktivierten Stresshormonrezeptors (Abb. 1). Dadurch wird letztlich die Kontrolle des Stresshormonsystems blockiert, was zu einer überschießenden Stressantwort führt. In vielen humangenetischen Studien konnte gezeigt werden, dass Polymorphismen des FKBP5-Gens nicht nur die Expression von FKBP5 beeinflussen, sondern auch das Risiko der Probanden, an einer Depression zu erkranken [2]. Besonders interessant ist dabei, dass frühkindliche Stresserlebnisse das Erkrankungsrisiko modulieren und vor allem in Kombination mit bestimmten DNA-Sequenzvarianten eine starke Erhöhung des Erkrankungsrisikos verursachen. [3].
FKBP5 korreliert mit Stressanfälligkeit
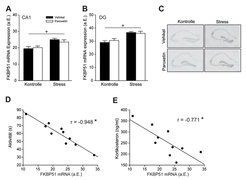
Abb. 2: (A-C) Werden männliche Mäuse chronischem Stress ausgesetzt, erhöht sich deren FKBP5-Expression in spezifischen Regionen des dorsalen Hippokampus (CA1, Dentate Gyrus (DG)). Eine zusätzliche Behandlung der Tiere mit dem Antidepressivum Paroxetin hat darauf keinen Einfluss. (D-E) Die Stärke der FKBP5-Aktivierung korreliert signifikant mit dem stressinduzierten Verhalten sowie der neuroendokrinen Regulation des Stresssystems. a.E: arbiträre Einheiten.
Basierend auf den beschriebenen klinischen Befunden haben Wissenschaftlerinnen und Wissenschaftler des Max-Planck-Instituts für Psychiatrie in München nun begonnen, die molekularen Grundlagen der Interaktion zwischen Stress, FKBP5 und Depression zu entschlüsseln. Am Anfang stand die Frage, ob die Aktivität des FKBP5-Gens im Gehirn von Mäusen durch akuten oder chronischen Stress beeinflusst werden kann. Es konnte gezeigt werden, dass akuter Stress zu einer Erhöhung der FKBP5-Expression in einer Reihe von Hirnarealen führt, die bekanntermaßen für die Regulation des Stresssystems und für psychiatrische Erkrankungen bedeutend sind [5]. Auch nach chronischem sozialen Stress, einem Tiermodell, das menschlichen Stresssituationen sehr nahe kommt, konnte eine vermehrte FKBP5-Expression beobachtet werden (Abb. 2A-C)[6]. Das Ausmaß der FKBP5-Regulation korreliert dabei in den gestressten Tieren mit deren verhaltensbiologischen und neuroendokrinen Parametern (Abb. 2D und 2E). Tiere mit besonders hohen FKBP5-Expressionswerten zeigten auch die höchsten Werte an passivem Verhalten in einer ausweglosen Stresssituation – ein Verhaltensmuster, das häufig mit Depression assoziiert wird. Auch die Ausschüttung der Stresshormone als Reaktion auf einen akuten Stress war direkt mit dem FKBP5-Expressionsniveau im Gehirn der Tiere verknüpft.
FKBP5-Knockout-Mäuse sind stressresistent

Abb. 3: (A-C) Mäuse mit einer Deletion des FKBP5-Gens zeigen nach chronischem Stress eine signifikant geringere Kortikosteron-Ausschüttung unter Basalbedingungen (A) sowie nach einem zusätzlichen akuten Stressfaktor (B und C). * signifikant unterschiedlich zu Wildtyp, # signifikant unterschiedlich zur Kontrollgruppe.
Die bisherigen Befunde legen den Schluss nahe, dass die Reduktion der FKBP5-Expression oder -Reaktivität im Gehirn zu einer sensitiveren Regulation des Stresshormonsystems und damit zu einer erhöhten Stressresistenz führt. Um diese Hypothese zu prüfen, wurden Mäuse mit einer Deletion des FKBP5-Gens (FKBP5-KO-Mäuse) chronischem sozialen Stress ausgesetzt [7]. Die resultierenden Ergebnisse konnten die Hypothese stützen. Vor allem hinsichtlich neuroendokriner Parameter zeigten FKBP5-KO Mäuse eine deutlich abgeschwächte Reaktion auf Stress (Abb. 3), was wahrscheinlich auf einer effektiveren Feedback-Kontrolle des Stresssystems dieser Tiere beruht. Was passiert nun, wenn man den molekularen Gegenspieler des FKBP5, das FKBP4 ausschaltet? Da FKBP4 ein funktioneller Agonist des Glukokortikoid-Rezeptors ist, müsste man hier eine erhöhte Stressempfindlichkeit vermuten. Tatsächlich zeigten FKBP4-KO-Mäuse ein erhöhtes Angstverhalten sowie eine stärkere Stresshormonaktivierung nach einem akuten Stressfaktor [8]. Weiterhin konnte auch eine verminderte Stress-Sensitivität festgestellt werden, was darauf hinweist, dass diese Ko-Chaperone eine differenzierte biologische Funktion ausüben, spezifisch für jeweilige Hirnareale.
FKBP5 als neues Target für potenzielle Antidepressiva
Die Befunde zur Funktion von FKBP5 aus der Grundlagenforschung schaffen zusammen mit den klinischen Studien eine gute Ausgangsposition für die Entwicklung von pharmakologischen Substanzen, die FKBP5 direkt modulieren. Es ist zu erwarten, dass FKBP5-Antagonisten als Medikamente eingesetzt werden können – speziell bei Patienten mit einer genetischen Veranlagung für eine erhöhte FKBP5-Expression und vor allem in Zusammenhang mit Stress- oder Trauma-Erlebnissen während der Kindheit. Im Max-Planck-Institut für Psychiatrie konnten bereits mehrere geeignete Moleküle entwickelt werden, deren Wirkung darin besteht, die stressinduzierten Effekte von FKBP5 zu unterdrücken. Solche Medikamente können sowohl nach einem traumatischen Erlebnis als auch zur Behandlung vielschichtiger stressinduzierter Erkrankungen eingesetzt werden. Die konzertierte Forschung hinsichtlich der Funktion von FKBP5 auf molekularer, struktureller, physiologischer und verhaltensbiologischer Ebene wird letztendlich zum Erfolg dieser neuartigen Behandlungsstrategien beitragen.


